基因表达的随机波动被称为“噪音”(Noise),这种波动的噪音通常被认为可能对机体有害,但是也有研究认为可能是有益的。对此,美国Gladstone研究所Leor S. Weinberger研究组在Science发表了他们的研究成果,题为 A DNA-repair pathway can affect transcriptional noise to promote cell fate transitions 。他们发现DNA修复信号通路可以通过影响转录噪音促进细胞命运的转化,并将该机制称为DiThR(Discordant Transcription through Repair)。

生物体内基因表达的分子波动会被基因调控环路所调节,在多种生物系统中对细胞命运以及细胞状态具有选择作用(图1)【1-3】。其中一个开放性的问题是细胞中的噪音控制是有位点特异性的基因调节环路还是由广泛化的基因表达噪音调节机制存在,以及这些机制对于细胞命运特化过程中的调节以及加强作用是否存在还尚未可知。
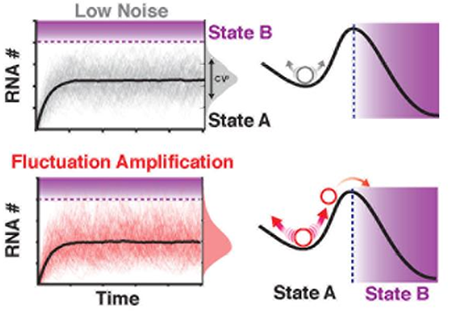
图1 基因表达噪音与细胞命运转化
基因表达的噪音可以非分为内在噪音(Intrinsic)与外源噪音(Extrinsic)。哺乳动物细胞中的内在噪音主要在源于启动子区域开放与关闭状态切换(Promoter toggling between ON and OFF states)引起的转录爆发(Transcriptional ‘bursts’),并且基因表达噪音的参数主要是由调节机器比如组蛋白乙酰转移酶相关,乙酰转移酶可以协助将启动子区域的核小体清除,从而增加平均的转录丰度【4】。而基因表达的增加则会伴随着噪音的降低。所以作者们好奇这其中噪音控制的破坏或者提高具体机制是什么。
为此,作者们进行了一系列的筛选,鉴定发现了一个化合物IdU(5’-iodo-2’-deoxyuridine),可以在多种细胞系统以及多种转录报告因子中提高基因表达的噪音。为了进一步证实该化合物在小鼠胚胎干细胞应用的普适性,作者们在施用了IdU之后进行了单细胞RNA测序,作者们发现IdU的加入会放大细胞与细胞之间转录丰度的可变性,这种变化覆盖了被分析的全部4,578个基因。进一步地,作者们用两种方式分别对细胞中基因表达的噪音改变以及均值进行定量化以及技术性统计,发现IdU会诱导显著的转录变化也就是基因表达的噪音但是几乎不会影响表达的均值。那么什么特征能够对基因噪音的提高进行表征呢?作者们对基因的长度、启动子、基因体AT含量、外显子数量、TATA box以及链的方向进行了检测。作者们发现高噪音敏感的基因更倾向于位于拓扑结构域(Topologically associated domians, TADs)的内部,该结果说明基因的拓扑结构对于噪音提高的敏感性具有一定的影响。
通过基因本体论分析,作者们发现高噪音敏感性的基因附近在一些管家基因信号通路中比如多能性维持的因子Sox2、Oct4、Nanog以及Klf4等。这些因子是细胞命运特化的关键因子,因此,作者们集中在放大的转录噪音对于细胞命运驱动的分子机制。通过基因调控网络外源噪音的变化也会逐渐传播。作者们发现,基因表达噪音的提高与外源的噪音不具有相关性也不一致。
进一步地,为了检测启动子切换对于IdU诱导基因表达噪音提高中的作用,作者们进行了单分子RNA FISH的实验,可以对Nanog新生的以及成熟的转录本进行分别的计数。作者们发现在IdU存在的情况下,活跃的转录中心中新生以及成熟的mRNAs均出现增加,而这种可变性会造成转录爆发的持续时间变短一起转录的比率放大。因此,IdU介导的基因表达噪音增加会导致转录活跃中心密度的增加。另外,作者们对基因表达噪音增加对蛋白的丰度的影响进行检测,发现Nanog蛋白发生了显著的增加,而且转录爆发会驱动Nanog状态的转变。
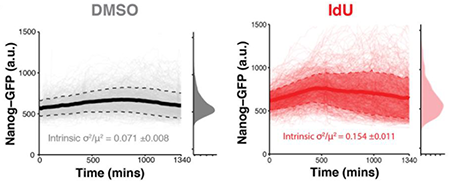
为了揭开其中的分子机制,作者们对影响噪音的14种核酸类似物进行了筛选。考虑到这些碱基修饰会通过碱基删除修复(Base-excision repair,BER)的方式被移除,作者们希望找到参与其中的调节因子。为此,作者们进行了一个CRISPRi为基础的筛选,鉴定发现了两个域DNA修复相关的因子Apex1(AP Endonuclease 1)以及Tk1(Thymidine kinase 1),这个两个因子的删除会废除基因表达噪音的升高。
为了验证Apex1对于噪音提高的作用是必须的,作者们试图建立一个Apex1敲除的小鼠胚胎干细胞品系。但是作者们发现Apex1的敲除是致死的。因此,作者们使用了对Apex1酶活性抑制剂进行处理,发现抑制剂与IdU的联用会在不影响基因表达的平均值的情况下显著增加Nanog表达的噪音。进一步地,作者们构建了一个催活失活型的Apex1的突变体,该突变体具有更高的结合DNA的亲和力。抑制剂的则会延长Apex1在DNA上的滞留能力,从而扩大DNA拓扑结构的形变。而催活失活型的Apex1会部分挽救IdU介导的噪音激活。而此过程主要是由于DNA的超螺旋的贡献,超螺旋与Apex1-DNA相互作用引发的基因表达噪音提高相关。
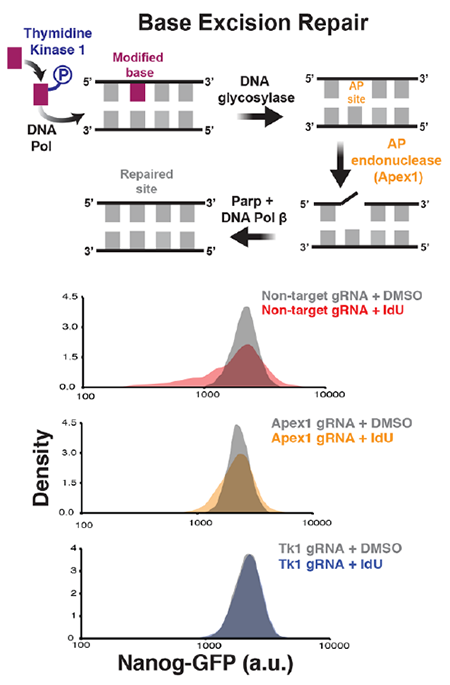
如果DNA的拓扑结构会影响转录爆发,那其他的超螺旋修饰因子可能也会影响Nanog的噪音。先前的研究表明,拓扑异构酶1以及2a会使得螺旋DNA变得松散。通过CRISPRi删除Top1以及Top2a后,Nanog蛋白的可变性显著增加。而在这些拓扑异构酶过表达的情况下则会部分消除IdU介导的噪音增加。因此,Apex1诱导的超螺旋是基因表达噪音扩大的显著驱动因子,但是此过程并不会影响基因表达的平均值,从而作者们建立了模型DiThR(Discordant Transcription through Repair)用以描述该分子机制。
总的来说,该工作发现DNA碱基切除修复会放大转录的噪音,而且DNA修复蛋白Apex1会通过识别DNA碱基修饰在不影响基因平均表达水平的情况下放大基因表达的噪音,揭示出DNA碱基修饰介导的转录波动对胚胎发育过程以及细胞命运分化的过程的关键分子机制。
原文链接:
https://science.sciencemag.org/lookup/doi/10.1126/science.abc6506
参考文献
1 Gupta, P. B. et al. Stochastic state transitions give rise to phenotypic equilibrium in populations of cancer cells. Cell 146, 633-644, doi:10.1016/j.cell.2011.07.026 (2011).
2 Weinberger, L. S., Burnett, J. C., Toettcher, J. E., Arkin, A. P. & Schaffer, D. V. Stochastic gene expression in a lentiviral positive-feedback loop: HIV-1 Tat fluctuations drive phenotypic diversity. Cell 122, 169-182, doi:10.1016/j.cell.2005.06.006 (2005).
3 Raj, A. & van Oudenaarden, A. Nature, nurture, or chance: stochastic gene expression and its consequences. Cell 135, 216-226, doi:10.1016/j.cell.2008.09.050 (2008).
4 Rodriguez, J. & Larson, D. R. Transcription in Living Cells: Molecular Mechanisms of Bursting. Annual review of biochemistry 89, 189-212, doi:10.1146/annurev-biochem-011520-105250 (2020).













